Моносахариды на примере глюкозы. Строение глюкозы. Видеоурок. Химия 10 Класс
На уроке будет рассмотрена тема: «Моносахариды на примере глюкозы. Строение глюкозы». На этом уроке вы изучите моносахариды на примере глюкозы. Вначале выведете общие закономерности ее поведения. Рассмотрите, как изобразить молекулярную формулу глюкозы, чтобы она передавала информацию о её пространственном строении и отражала особенности её поведения.
На основании химических свойств глюкозы легко вывести общие закономерности её поведения, а именно: в ней присутствуют спиртовые группы и альдегидные группы. Можно попытаться изобразить её молекулярную и структурную формулу. Этой же формуле соответствует изомер глюкозы – галактоза. В середине молекулы глюкозы содержится 4 асимметрических атома углерода, т. е. обладающих оптической активностью. Значит, что каждый из них может дать глюкозе оптические изомеры. Чтобы формула передавала пространственное строение глюкозы, нужно изобразить её особенным образом, чтобы гидроксогруппы располагались справа и слева от цепочки. Имеем стандартную проекционную форму. Рис. 1.
Рис. 1. Структурная формула глюкозы
Но кроме таких формул в научной литературе применяются более простые формы, не изображают серединные атомы углерода и получается такое графическое изображение:
На приведенных проекционных формулах изображены различные углеводы, т. е. те, которые наиболее широко распространены. Рис. 2.
Рис. 2. Проекционные формулы углеводов
Здесь видно, что углевод фруктоза не содержит альдегидной группы в отличие от глюкозы, а вместо неё содержит кетонную группу. Из-за этого химические свойства глюкозы и фруктозы несколько отличаются. Но все равно эти формулы не отражают тех реальных формул, в виде которых эти углеводы существуют в живой природе.
Все углеводы находятся в циклической форме. Потому что осуществляется взаимодействие между альдегидной и спиртовой группой в самой глюкозе. В результате этого получается циклическое строение глюкозы. В водных растворах менее 1% глюкозы существует вне циклической формы. Практически все водные растворы являются циклами. Рис. 3. Образующийся шестичленный цикл является гетероциклом, т. к. включает атом кислорода. Все углеводы в водной среде находятся в циклической форме.
Рис. 3. Циклическая глюкоза
Подведение итога урока
На уроке была рассмотрена тема: «Моносахариды на примере глюкозы. Строение глюкозы». На этом уроке вы изучили моносахариды на примере глюкозы. Вначале вывели общие закономерности ее поведения. Рассмотрели, как изобразить молекулярную формулу глюкозы, чтобы она передавала информацию о её пространственном строении и отражала особенности её поведения .
Список литературы
- Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
- Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин, А.А. Дроздов, В.И. Теренин. – М.: Дрофа, 2008. – 463 с.
- Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин, А.А. Дроздов, В.И. Теренин. – М.: Дрофа, 2010. – 462 с.
- Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Домашнее задание
- №№ 3, 4 (с. 137) Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
- Как опытным путем можно доказать, что в молекуле глюкозы есть альдегидная группа?
- Изобразите циклическую формулу фруктозы.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Органическая химия (Источник).
- Сайт о химии (Источник).
- Интернет-портал promobud.ua (Источник).
interneturok.ru
нахождение в природе, строение молекулы, изомерия, физические свойства и химические свойства, получение. Общие представления об олигосахаридах». 10 класс
10 класс. Дата
Урок №25 . План-конспект по теме: «Углеводы. Глюкоза: нахождение в природе, строение молекулы, изомерия, физические свойства и химические свойства, получение. Общие представления об олигосахаридах».
Цель урока: дать представление об углеводах на примере глюкозы; познакомить обучающихся с составом и строением молекулы глюкозы, её физическими свойствами, значением в природе, научить определять химические свойства органических соединений, исходя из их строения и наличия соответствующих функциональных групп на примере глюкозы как альдегидоспирта; раскрыть общие представления об олигосахаридах на примере сахарозы.
Оборудование и материалы: Таблица «Классификация углеводов», штатив с пробирками, пробиркодержатель, спиртовка, раствор глюкозы, сахарозы, растворы сульфата меди (II), гидроксида натрия, презентация по данной теме.
Тип урока: изучение нового материала.
Методы обучения: словесные, пояснительно-иллюстративные, практические: проведение лабораторного эксперимента, репродуктивные; частично поисковые, интерактивные.
Задачи урока: Обучающие:
• Закрепить понятия «углеводы», «альдегидоспирт», «альдегидная форма глюкозы», «циклическая α- и β- формы»; закрепить навыки обучающихся составлять уравнения реакций получения и свойства глюкозы и сахарозы;
• закрепить навыки составлять структурные формулы α- и β- формы глюкозы;
• научить прогнозировать химические свойства органических соединений, исходя из их строения и наличия соответствующих функциональных групп на примере глюкозы как альдегидоспирта.
Развивающие:
• Продолжить применять компетентностный подход при изучении строения и свойств углеводов на примере глюкозы и сахарозы; познакомить обучающихся с качественными реакциями на глюкозу и сахарозу; развивать логическое мышление, умения наблюдать, анализировать и сравнивать, находить причинно-следственные связи, делать выводы, формировать заинтересованность предметом.
• Формировать экологическую сознательность обучающихся при рассмотрении пищевой ценности глюкозы; познакомить обучающихся с распространением углеводов в природе, их биологической ролью, применением; формировать научное мировоззрение обучающихся; совершенствовать трудовые навыки;
• научить обучающихся расширять свои знания об органических кислородсодержащих веществах на примере углеводов, их свойствах; научить слышать учителя и своих одноклассников, быть внимательным к себе и окружающим, оценивать себя и других, вести беседу.
Структура урока:
I. Организационный этап. 1 мин
II. Проверка домашнего задания. 5 мин
III. Актуализация опорных знаний. Мотивация учебной деятельности. 5 мин
IV. Изучение нового материала. 23 мин
1. Понятие об углеводах;
2. Строение молекулы, свойства и получение глюкозы;
3. Применение глюкозы;
4. Представления об олигосахаридах.
V. Первичное применение полученных знаний. 6 мин
VI. Домашнее задание. 2 мин
VII. Подведение итогов урока. 3 мин
Ход урока:
I. Организационный этап.
Приветствие, диагностика состояния обучающихся, настрой на работу. Учитель сообщает цель и задачи урока; проводит инструктаж по выполнению работы на уроке.
II. Проверка домашнего задания.
Проверка домашнего задания устно у доски.
Опрос.
1. Что называется жирами?
2.Физические и химические свойства жиров?
3.Синтетические моющие средства.
III. Актуализация опорных знаний. Мотивация учебной деятельности.
Беседа. В курсе биологии вы уже знакомились с углеводами, давайте вспомним основные понятия.
1. Что вы знаете о составе углеводов?
2. Что вы знаете о физических свойствах углеводов?
3. Что вы знаете о биологическом значении углеводов?
IV. Изучение нового материала.
Параллельно с изучением новой темы просматриваем презентацию по данной теме.
1. Понятие об углеводах.
Совместно с учителем обучающиеся дают определение углеводам, записывают в тетрадь.
Углеводами называют вещества с общей формулой Cx(H2O)y, где x и y – натуральные числа. Название «углеводы» говорит о том, что в их молекулах водород и кислород находятся в том же отношении, что и в воде.В животных клетках содержится небольшое количество углеводов, а в растительных – почти 70 % от общего количества органических веществ.
КЛАССИФИКАЦИЯ УГЛЕВОДОВ
ПРОСТЫЕ СЛОЖНЫЕ
моносахариды (дисахариды,
полисахариды)
Проблемный вопрос: Какие функциональные группы содержатся в углеводах – моносахаридах. Находим ответ на вопрос совместно. Исходя из химических свойств, характерных для глюкозы и фруктозы (качественные реакции) делаем вывод о наличии функциональных групп. Этот вопрос рассмотрим позже. Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (альдегидная или кетонная) и несколько гидроксильных.
Наиболее распространены моносахариды, в молекулах которых содержится пять углеродных атомов (пентозы) или шесть (гексозы).
Например:
Из этих формул следует, что моносахариды – это альдегидоспирты или кетоноспирты.
2. Строение глюкозы C6H12O6
Экспериментально установлено, что в молекуле глюкозы присутствуют альдегидная и гидроксильная группы.
В результате взаимодействия карбонильной группы с одной из гидроксильных глюкоза может существовать в двух формах: открытой цепной и циклической.
В растворе глюкозы эти формы находятся в равновесии друг с другом.
Например, в водном растворе глюкозы существуют следующие структуры:
Циклические α- и β — формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца. В α-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе -СН2ОН, в β-глюкозе – в цис-положении. С учетом пространственного строения шестичленного цикла формулы этих изомеров имеют вид:
В твёрдом состоянии глюкоза имеет циклическое строение. Обычная кристаллическая глюкоза – это α- форма. В растворе более устойчива β-форма (при установившемся равновесии на неё приходится более 60% молекул). Доля альдегидной формы в равновесии незначительна.
Для глюкозы характерна межклассовая изомерия – фруктоза.
Строение фруктозы.
Фруктоза — изомер и «близкий родственник» глюкозы. Она хорошо растворима в воде, имеет сладкий вкус (примерно в 3 раза слаще глюкозы).
Фруктоза также наиболее часто встречается в циклических формах (α- или β) но, в отличие от глюкозы, в пятичленных.
Фруктоза и глюкоза в больших количествах содержатся в сладких фруктах, пчелином меде.
Физические свойства глюкозы:
Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» – сладкий):
1) она встречается почти во всех органах растения: в плодах, корнях, листьях, цветах;
2) особенно много глюкозы в соке винограда и спелых фруктах, ягодах;
3) глюкоза есть в животных организмах;
4) в крови человека ее содержится примерно 0,1 %.
Получение глюкозы.
В промышленности. Гидролиз крахмала:
(C6H10O5)n + nH2O t,H+→ nC6H12O6
крахмал глюкоза
В лаборатории. Из формальдегида (1861 г А.М. Бутлеров):
6 HCOH Ca(OH)2→ C6H12O6
формальдегид
В природе. Фотосинтез:
6CO2 + 6H2O hν, хлорофилл → C6H12O6 + 6O2
Другие способы. Гидролиз дисахаридов:
C12H22O11 + H2O t,H+→ 2C6H12O6
мальтоза глюкоза
C12H22O11 + H2O t,H+→ C6H12O6 + C6H12O6
сахароза глюкоза фруктоза
Химические свойства глюкозы.
I. Специфические свойства.
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
C6H12O6 → 2C2H5OH + 2CO2↑
2. Молочнокислое брожение:
2C3H6O3 → C6H12O6
3. Маслянокислое брожение:
C6H12O6 → C3H7COOH + 2H2↑+ 2CO2↑
II. Свойства альдегидов.
1. Реакция серебряного зеркала:
СH2OH(CHOH)4-COH + Ag2O t.Nh4→ СH2OH(CHOH)4-COOH + 2Ag↓
глюконовая кислота
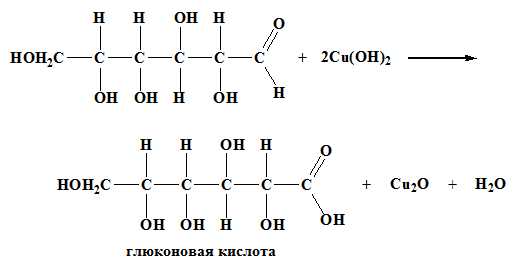
Лабораторные опыты: 10. Взаимодействие глюкозы со гидроксидом меди (II) при нагревании.
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O + 2H2O
голубой красный 3. Восстановление:
СH2OH(CHOH)4-COH + H2 t,Ni → СH2OH(CHOH)4CH2OH
сорбит – шестиатомный спирт
III. Свойства многоатомных спиртов.
и при обычных условиях:
1. Качественная реакция многоатомных спиртов.
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета.

(глюкозат меди (II) – синий раствор)
3. Применение глюкозы.
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется углекислый газ и вода, при это выделяется энергия согласно итоговому уравнению:
C6H12O6 + 6O2 → 6H2O + 6CO2 + 2800 кДж
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива.
4. Сахароза. Нахождение в природе. Свойства, применение.
Примером наиболее распространенных в природе дисахаридов (олигосахаридом) является сахароза (свекловичный или тростниковый сахар).
Олигосахариды – это продукты конденсации двух или нескольких молекул моносахаридов.
Дисахариды – это углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.
Физические свойства и нахождение в природе.
1. Она представляет собой бесцветные кристаллы сладкого вкуса, хорошо растворима в воде.
2. Температура плавления сахарозы 160 °C.
3. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
4. Содержится во многих растениях: в соке березы, клена, в моркови, дыне, а также в сахарной свекле и сахарном тростнике.
Строение и химические свойства.
1. Молекулярная формула сахарозы – С12Н22О11
2. Сахароза имеет более сложное строение, чем глюкоза. Молекула сахарозы состоит из остатков глюкозы и фруктозы, соединенных друг с другом.
3. Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
Лабораторные опыты: 11. Взаимодействие сахарозы с гидроксидом меди (II).
Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди (качественная реакция многоатомных спиртов 4. Альдегидной группы в сахарозе нет: при нагревании с аммиачным раствором оксида серебра (I) она не дает «серебряного зеркала», при нагревании с гидроксидом меди (II) не образует красного оксида меди (I).
5. Сахароза, в отличие от глюкозы, не является альдегидом. Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала», так как не способна превращаться в открытую форму, содержащую альдегидную группу. Подобные дисахариды не способны окисляться (т.е. быть восстановителями) и называются невосстанавливающими сахарами.
6. Сахароза является важнейшим из дисахаридов.
7. Она получается из сахарной свеклы (в ней содержится до 28 % сахарозы от сухого вещества) или из сахарного тростника. Реакция сахарозы с водой.
Важное химическое свойство сахарозы – способность подвергаться гидролизу (при нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы:
С12Н22О11 + Н2О t, h3SO4→ С6Н12O6 + С6Н12O6
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
Из числа изомеров сахарозы, имеющих молекулярную формулу С12Н22О11, можно выделить мальтозу и лактозу.
Применение сахарозы.
· Продукт питания;
· В кондитерской промышленности;
· Получение искусственного мёда.
V. Первичное применение полученных знаний.
Составление уравнений реакций по цепочкам превращений:
1 ряд: Углекислый газ → глюкоза → этанол →этилпропанат → углекислый газ;
2 ряд: Метаналь → глюкоза → молочная кислота→ углекислый газ;
3 ряд: Сахароза → глюкоза →этанол → этилен → бромэтан.
VI. Домашнее задание.
Изучить материал темы по учебнику, выполнить задания после параграфа. Подготовить презентацию: сравнение строения и свойств крахмала и целлюлозы.
VII. Подведение итогов урока.
Подведение итогов урока.
Предлагаю обучающимся следующий рефлексивный тест:
1. Я узнал (узнала) много нового.
2. Мне это пригодится в жизни.
3. На уроке было о чём подумать.
4. На все вопросы, которые возникли на уроке, я нашёл (-ла) ответы.
5. На уроке я поработал (-ла) отлично и цели урока достиг (-ла).
infourok.ru
«Углеводы. Глюкоза, строение, свойства, применение»
Разделы: Химия
1.Образовательные задачи: продолжить формирование понятия “функциональная группа”, закрепление умения писать реакции, характеризующие окислительные и восстановительные свойства многоатомных спиртов.
2.Воспитательные задачи: формирование умения устанавливать причинно-следственные связи.
3.Задачи развития учащихся: развитие познавательных интересов, выработка умений сравнивать, классифицировать, обобщать изучаемые свойства, преодолевать трудности в учении.
Наглядность и оборудование: таблица №1 “Содержание некоторых жизненно важных веществ и энергетическая ценность пищевых продуктов (на 100 г. продукта)”; таблица №2 “Идентификация органических веществ”; схема 1 “Классификация углеводов”; схема 2 “Циклическое строение глюкозы”; портреты ученых химиков; информационные таблицы.
На столах учащихся лотки для выполнения лабораторных опытов, имеются следующие реактивы: кристаллическая глюкоза, раствор глюкозы, лакмус, раствор МаОН, раствор СиSO4, Аg2О в аммиачном растворе; химическая посуда, спиртовка.
ХОД УРОКА.
1. Вступительное слово учителя:
“Белки, жиры и углеводы,
Пройдут века, эпохи, годы,
К вам мы прикованы на век,
Без вас немыслим человек”.
Углеводы… А это те самые сладости, которые вы так любите, (фрукты, торты, конфеты, варенье, шоколад и т.д., особенно много углеводов содержит виноград). Углеводы жизненно важные вещества, которые необходимы каждому организму. Эти вещества расходуются, и человек должен постоянно пополнять их запасы. Понятно, что вещества, входящие в состав тканей организма, не похожие на те, которые он употребляет в пищу. Организм человека перерабатывает пищевые продукты и в процессе своей жизнедеятельности постоянно расходует энергию, которая, как мы знаем, выделяется при окислении в тканях организма, углеводы входят в состав нуклеиновых кислот, осуществляющих биосинтез белка и передачу наследственных признаков.
— Обратим внимание на табл. 1. Какие вещества
содержат и богаты углеводами?
Ответ и вывод ученика: Углеводы — обширный класс
природных соединений.
— Обратимся к схеме 1. “Классификация углеводов”. Обратите внимание на происхождение названий. (Прослеживаем аналогию названий с предельными углеводородами: гексоза, пентоза…).
Углеводы часто называют сахаристыми веществами или сахарами. Они могут быть безвкусными, сладкими и горькими.
Историческая справка (готовит ученик).
- Углеводы используются с глубокой древности - самым первым углеводом (точнее смесью углеводов), с которой познакомился человек, был мёд.
- Родиной сахарного тростника является
северо-западная Индия-Бенгалия. Европейцы
познакомились с тростниковым сахаром благодаря
походам Александра
Македонского в 327 г. до н.э. - Свекловичный сахар в чистом виде был открыт лишь в 1747 г. немецким химиком А. Маргграфом.
- Крахмал был известен ещё древним грекам.
- Целлюлоза, как составная часть древесины, используется с глубокой древности.
6.Термин слова “сладкий” и окончание —оза- для
сахаристых веществ было
предложено французским химиком Ж. Дюла в 1838 г.
Исторически сладость была главным признаком, по которому то или иное вещество относили к углеводам.
- В 1811 г. русский химик Кирхгоф впервые получил
глюкозу гидролизом крахмала, а впервые
правильную эмпирическую формулу глюкозы
предложил шведский
химик Я. Берцемус в 1837 г. С6Н12О6 - Синтез углеводов из формальдегида в
присутствии Са(ОН)2 был произведён
А.М. Бутлеровым в 1861 г.
Вопрос: Глядя на формулы углеводов (схема 1) ответьте — одинаково ли соотношение Н2 и О2 в углеводах и воде?
Ответ: 2:1
На основе этой аналогии русский химик К. Шмидт в 1844 г. предложил термин углевода (углерод и вода), а общая формула углеводов Сn(Н2 О)
Вопрос: Итак, важнейшим представителем моносахаридов является глюкоза. Мы встречались с вами с этим веществом при изучении каких тем в курсе химии? Биологии?
Ответ: химия — альдегиды, спирты.
биология — фотосинтез, строение клетки и д.р.
— Где встречается глюкоза в природе? Организме человека?
— Вспомните, какими способами можно получить глюкозу (Ответ и запись уравнений реакций на доске).
Реакция фотосинтеза.
6СО2 + Н2О хлорофилл С6Н12О6 + 6О2 +Q
Реакция полимеризации.
Гидролиз крахмала (уравнение записывает учитель).
Вопрос: У вас в лотках кристаллическое вещество глюкоза и раствор глюкозы. Охарактеризуйте физические свойства глюкозы, (бесцветное кристаллическое вещество, хорошо растворимо в воде, сладкое на вкус, температура плавления 146 С.).
Учитель: Относительная сладость сахара = 1, глюкозы = 0,7.
Молекулярная формула глюкозы С6Н12О6 показывает, что в молекуле должны быть кислородосодержащие, функциональные группы. Прежде чем перейти к строению молекулы, мы с вами проведём лабораторные опыты.
Лабораторные опыты.
Задание 1. Испытайте раствор глюкозы на кислотные свойства лакмусом.
— Результат отрицательный.
Задание 2. Вопрос. — Как опытным путём доказать, что выданное вам вещество — глицерин.
Ответ. Растворяется с раствором Сn(ОН)2 .
Проделайте подобный опыт с раствором глюкозы. Сделайте на основании наблюдений вывод.
Ответ. Вывод: раствор глюкозы приобретает ярко-синее окрашивание подобно тому, как это происходит с глицерином, следовательно, в молекуле глюкозы много спиртовых групп.
Задание 3. Подогрейте полученный ярко-синий раствор. Что наблюдаете?
Ответ. Вывод: при нагревании ярко-синего раствора, мы получили красный осадок, это доказывает наличие альдегидной группы.
Учитель: Сделаем предположение, что в молекуле 1 альдегидная группа, то спиртовых соответственно будет 5. О наличии 5-и гидроксильных групп подтверждает сложный эфир глюкозы, содержащий 5 остатков уксусной кислоты и экспериментально доказывает что все атомы С связаны между собой в прямую цепь. Запишем формулу, выражающую глюкозы:
Установлено, что у третьего атома С группа — ОН расположена иначе, чем у других атомов С и распространённое строение глюкозы выглядит так:
Вывод: таким образом глюкоза - альдегидоспирт, точнее — многоатомный альдегидоспирт.
Установлено, что в растворе глюкозы находится не только её альдегидная форма; но и молекулы циклического строения (см. схема 2),
Превращение молекулы линейного строения в молекулу циклического строения объяснимо, если вспомнить что атомы С могут вращаться вокруг сигма-связей. Альдегидная группа может приблизиться к спиртовой группе 5-го атома С, поскольку атом О2 карбонильной группы несёт на себе частичный — заряд, а атом Н2 спиртовой группы — частично + заряд.
Осуществляется своеобразный химический процесс: происходит разрыв ?-связи карбонильной труппы, к атому О2 присоединяется атом Н25 а атом О2 спиртовой группы с атомом С замыкают цепь. Циклические формы находятся в равновесии, превращаясь ? и ? форму. Таким образом, в водном растворе глюкозы находятся три изомерные формы. Молекула кристаллической глюкозы —а — форма, при растворении в воде - открытая форма, а затем снова циклическая ? —форма. Такая изомерия называется динамической (таутомерия),
— Работа с учебником. Познакомимся с изомером глюкозы — фруктозой. Стр. 127.
(Учащиеся читают абзац, записывают формулу, делают вывод).
— Выяснив строение глюкозы, вернёмся к проделанным лабораторным опытам иопределим некоторые химические свойства. (Учащиеся пользуются таблицей №2).
— Учащиеся делают обоснование и записывают уравнение реакций:
1).
2) Лабораторный опыт.
Вопрос. — Докажите наличие альдегидной группы ещё одним опытом (реакция “Серебряного зеркала”) запишите уравнение реакции:
3). Альдегидная группа может быть восстановлена в спиртовую действием Н2 в присутствии катализатора (реакция ?-связь).
Вопрос: — Какой спирт образовался?
Ответ: Шестиатомный.
Реакции обусловленные наличием в молекуле гидроксильных групп — это:
взаимодействие с карбоновыми кислотами, образуются сложные эфиры;
взаимодействие с гидроксидом меди (II), образуется алкоголят меди (II).
(Уравнения реакции не записываем).
Специфические свойства.
Большое значение имеют процессы брожения глюкозы, происходящие под действием органических катализаторов-ферментов (они вырабатываются микроорганизмами).
— Предлагаем учащимся записать уравнение реакции:
а) спиртовое брожение (под действием дрожжей).
б) молочнокислое брожение (под действием молочнокислых бактерий).
(уравнение записывается с помощью учителя).
в) маслянокислое брожение.
Биологическое значение глюкозы, её применение (сообщение ученика).
Информация учебника (с. 128) + дополнительный материал
Глюкоза — необходимый компонент пищи, один из главных участников обмена веществ в организме, очень питательна и легко усваивается. При её окислении выделяется больше трети используемой в организме энергий ресурс — жиры, но роль жиров и глюкозы в энергетике разных органов различна. Сердце в качестве топлива используется жирные кислоты. Скелетным мышцам глюкоза нужна для “запуска”, а вот нервные клетки, в том числе и клетки головного мозга работают только на глюкозе. Их потребность составляет 20-30% вырабатываемой энергии. Нервным клеткам энергия нужна каждую секунду, а глюкозу организм получает при приёме пищи (+ другая информация + таблица №1).
Вывод по уроку делает учитель совместно с учащимися
(вопросы учебника 1-7 устно с. 137)
Домашнее задание с. 125-129.
Записать химические свойства рибозы, если известно, что она, как и глюкоза альдегидоспирт, имеет подобное строение молекулы и свойства.
Приложения
Оформление доски 1, 2, 3, 4
Схема 1
Схема 2
Таблица 1
Таблица 2
18.02.2005
urok.1sept.ru
Строение, применение глюкозы
Название «углеводы» возникло потому, что первые изученные представители этого класса соединений состояли как бы из углерода и воды: они имели состав, выражающийся общей формулой Сn(Н2О)m. Позднее, однако, были найдены углеводы, не отвечающие этой формуле, но, бесспорно, по другим признакам относящиеся к этому же классу веществ.
Одним из простейших углеводов является глюкоза.
Физические свойства и нахождение в природе
Глюкоза — бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» — сладкий). Она встречается почти во всех органах растения: в плодах, корнях, листьях, цветах. Особенно много глюкозы в соке винограда и в спелых фруктах, ягодах. Глюкоза есть в животных организмах. В крови человека ее содержится примерно 0,1%.
Строение глюкозы
Состав глюкозы выражается формулой С6Н12Об. Попытаемся выяснить строение этого углевода.
Так как в составе молекулы имеется кислород, то возникает вопрос: не содержит ли она уже известные нам функциональные группы атомов?
Поскольку в молекуле глюкозы сравнительно много кислородных атомов, можно высказать предположение прежде всего о принадлежности ее к многоатомным спиртам. Если раствор этого вещества прилить к свежеосажденному гидроксиду меди (II), образуется ярко-синий раствор, как это мы наблюдали в случае глицерина. Опыт, таким образом, подтверждает принадлежность глюкозы к многоатомным спиртам.
Но тогда возникает вопрос: сколько же гидроксильных групп содержится в молекуле?
Известен сложный эфир глюкозы, в молекуле которого пять остатков уксусной кислоты. Из этого следует, что в молекуле углевода пять гидроксильных групп. Этот факт уже объясняет, почему глюкоза хорошо растворяется в воде и имеет сладкий вкус.
Остается выяснить характер еще одного кислородного атома. Если раствор глюкозы нагреть с аммиачным раствором оксида серебра (I), то получится характерное серебряное зеркало. Значит, шестой атом кислорода в молекуле вещества входит в состав альдегидной группы.
Чтобы составить полное представление о строении глюкозы, надо знать, как построен скелет молекулы. Поскольку все шесть атомов кислорода входят в состав функциональных групп, следовательно, атомы углерода, образующие скелет, соединены друг с другом непосредственно. Установлено, что цепь атомов углерода прямая, а не разветвленная. Наконец, учтем, что альдегидная группа может находиться только в конце неразветвленной углеродной цепи (почему?) и что гидроксильные группы могут быть устойчивы, находясь лишь у разных атомов углерода.
На основании всех этих данных химическое строение глюкозы можно выразить такой формулой:
Следовательно, глюкоза одновременно и альдегид и многоатомный спирт — она альдегидоспирт.
Исследования ученых показали, что в ее растворе содержатся молекулы не только с открытой цепью атомов, но и циклические, в которых нет альдегидной группы.
Что же представляют собой циклические молекулы глюкозы? Молекула глюкозы может принять форму, когда альдегидная группа близко подойдет к пятому углеродному атому. Тогда произойдет ее взаимодействие с гидроксильной группой, аналогичное известному нам присоединению воды к альдегидам, где образуется новая гидроксильная группа. Это приведет к замыканию молекулы через кислородный атом в шестичленное кольцо, и альдегидной группы в такой молекуле уже не будет:
Процесс превращения альдегидной формы в циклическую обратим. В растворе существует подвижное равновесие между ними. Оно сильно смещено в сторону образования циклической формы.
Циклическое строение веществ часто изображают формулами
по формуле можно судить, например, по какую сторону плоскости кольца (сверху или снизу) находятся гидроксильные группы в молекуле.
Молекулы глюкозы могут иметь и иную циклическую форму Вследствие свободного вращения альдегидной группы вокруг связи C—C образующаяся при замыкании цикла гидроксильная группа может оказаться у первого углеродного атома над плоскостью или под плоскостью кольца. В результате образуются две циклические формы:
Циклическая форма, в которой гидроксильная группа образуется по ту же сторону кольца, что и находящаяся при втором атоме углерода, называется a-формой Если же гидроксильная группа оказывается расположенной по разные стороны с находящейся при втором атоме, это будет b-форма глюкозы.
Кристаллическая глюкоза состоит из циклических молекул a-формы. При растворении в воде образуются и молекулы b-формы Это превращение идет через промежуточное образование молекул альдегидной формы.
Химические свойства
Рассмотрим химические свойства альдегидной формы глюкозы. На основании строения мы можем заключить, что глюкоза — вещество с двойственной химической функцией.
Как многоатомный спирт, глюкоза образует эфиры:

Как альдегид, она окисляется окисляется под действием аммиачного раствора оксида серебра (I).

Окислителем альдегидной группы глюкозы может служить и гидроксид меди (II). Если к небольшому количеству свежеосажденного гидроксида меди (II) прилить раствор глюкозы и смесь нагреть, то образуется красный оксид меди (I).
Альдегидная группа глюкозы может быть восстановлена. Тогда образуется шестиатомный спирт:
СН2ОН—СНОН—СНОН—СНОН—СНОН—СН2ОН
Важным химическим свойством глюкозы является ее брожение под действием органических катализаторов — ферментов, вырабатываемых микроорганизмами.
Известно несколько видов брожения.
Спиртовое брожение идет под действием фермента дрожжей.
C6H12O6→ 2C2H5OH + 2CO2
Молочнокислое брожение глюкозы происходит под действием фермента молочнокислых бактерий:
C6H12O6→ 2C3H6O3
Маслянокислое брожение глюкозы:
C6H12O6→ C3H7COOH + 2H2 + 2CO2
Образующаяся молочная кислота – соединение с двойственной химической функцией, в ней сочетаются свойства спирта и карбоновой кислоты.
Процесс образования молочной кислоты происходит при скисании молока. Появление кислоты в молоке можно установить при помощи лакмуса.
Молочнокислое брожение имеет большое значение в переработке сельскохозяйственных продуктов. С ним связано получение целого ряда молочных продуктов: простокваши, творога, сметаны, сыра. Молочная кислота образуется в процессе квашения капусты, силосования кормов и выполняет при этом консервирующую роль. Накапливаясь в плотно уложенной силосуемой массе, она способствует созданию кислотной среды, в которой не могут развиваться процессы гниения белков и другие вредные химические превращения; это ведет к получению доброкачественного, высокопитательного, сочного корма для скота.
Применение глюкозы
Глюкоза — ценное питательное вещество. Как вам известно из курса биологии, крахмал пищи в пищеварительном тракте превращается в глюкозу, которая кровью разносится по всем тканям и клеткам организма. В клетках происходит окисление глюкозы.
Как вещество, легко усваиваемое организмом и дающее ему энергию, глюкоза находит и непосредственное применение в качестве укрепляющего лечебного средства. Сладкий вкус обусловил применение ее в кондитерском деле (в составе патоки) при изготовлении мармелада, карамели, пряников и т. д. Как восстановитель, она используется при изготовлении зеркал и елочных украшений (серебрение). В текстильной промышленности глюкоза применяется для отделки тканей. Брожением глюкозы могут быть получены молочная кислота и другие продукты. В технике глюкозу получают из боолее сложных углеводов, преимущественно из крахмала, нагревая? его с водой в присутствии катализаторов — минеральных кислот.
Фруктоза как изомер глюкозы
Известен ряд других углеводов, состав которых отвечает формуле С6Н12О6. Все они являются, следовательно, изомерами и как вещества, содержащие шесть атомов углерода в молекуле, называются гексозами. Распространенный их представитель – фруктоза:
Как показывает строение, фруктоза – кетоноспирт. Она содержится в сладких плодах, равные количества фруктозы и глюкозы составляют основную часть пчелиного меда.
Фруктоза слаще глюкозы и обыкновенного сахара.
Известны углеводы с пятью углеродными атомами в молекуле — пентозы (рибоза С5Н10О5 и дезоксирибоза C5H10O4 — кристаллические вещества сладкого вкуса, растворимые в воде).
Физические свойства и нахождение в природе сахарозы
Сахароза хорошо известна нам в виде обычного сахара. Она представляет собой бесцветные кристаллы сладкого вкуса, очень хорошо растворима в воде. Температура плавления сахарозы 160 °С; при застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
Сахароза содержится во многих растениях: в соке березы, клена, в моркови, дыне. Особенно много ее в сахарной свекле и сахарном тростнике; из них и получают сахарозу.
Строение и химические свойства
Молекулярная формула сахарозы С12Н22О11. Сахароза имеет более сложное строение, чем глюкоза. Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов. Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди.
Наличие альдегидной группы в сахарозе установить не удается: при нагревании с аммиачным раствором оксида серебра (I) она не дает серебряного зеркала, при нагревании с гидроксидом меди (II) не образует красного оксида меди (I). Следовательно, сахароза, в отличие от глюкозы, не является альдегидом.
Важные данные для суждения о строении сахарозы можно получить на основе изучения ее реакции с водой. Прокипятим раствор сахарозы с несколькими каплями соляной или серной кислоты. Затем нейтрализуем кислоту щелочью и после этого нагреем раствор с гидроксидом меди (II). Выпадает красный осадок. Очевидно, при кипячении раствора сахарозы появились молекулы с альдегидными группами, которые и восстановили гидроксид меди (II) до оксида меди (I). Изучение этой реакции показывает, что сахароза при каталитическом действии кислоты подвергается гидролизу, в результате чего образуются глюкоза и фруктоза:
C12H22O11 + H2O → C6H12O6 + C6H12O6
Следовательно, можно считать, что молекула сахарозы состоит из соединенных друг с другом остатков глюкозы и фруктозы.
Из числа изомеров сахарозы, имеющих молекулярную формулу С12Н22О11, отметим здесь мальтозу и лактозу.
biofile.ru
10 класс. Химия. Моносахариды на примере глюкозы. Строение глюкозы — Моносахариды на примере глюкозы.
В природе наиболее распространены моносахариды, в молекулах которых содержится пять углеродных атомов (пентозы) или шесть (гексозы). Моносахариды — гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (альдегидная или кетонная) и несколько гидроксильных. Например:
Таким образом, моносахариды — это полигидроксиальдегиды (рибоза, глюкоза) или полигидроксикетоны (фруктоза).
Однако не все свойства моносахаридов согласуются с таким строением. Так, моносахариды не участвуют в некоторых реакциях, типичных для карбонильной группы. Одна из гидроксигрупп отличается повышенной реакционной способностью и ее замещение на группу -OR приводит к исчезновению свойств альдегида (или кетона).
Это приводит к выводу, что моносахаридам, кроме приведенных формул, свойственна также иная структура, возникающая в результате внутримолекулярной реакции между карбонильной группой с одним из спиртовых гидроксилов.
Реакция присоединения спирта к альдегиду приводит к образованию полуацеталя R-CH(OH)R’. Такая реакция внутри одной молекулы сопровождается ее циклизацией, т.е. образованием циклического полуацеталя.
Известно, что наиболее устойчивыми являются 5-ти и 6-ти членные циклы. Поэтому, как правило, происходит взаимодействие карбонильной группы с гидроксилом при 4-м или 5-м углеродном атоме (нумерация начинается с карбонильного углерода или ближайшего к нему конца цепи).
Таким образом, в результате взаимодействия карбонильной группы с одной из гидроксильных моносахариды могут существовать в двух формах: линейной (оксо-форме) и циклической (полуацетальной). В растворах моносахаридов эти формы находятся в равновесии друг с другом. Например, в водном растворе глюкозаы существуют следующие структуры:
Циклические a-
www.kursoteka.ru
Глюкоза строение и свойства — Справочник химика 21
Имеющаяся в этом соединении альдегидная группа обладает, как известно, способностью легко окисляться и может полностью объяснить наличие у глюкозы восстанавливающих свойств. Приведенная выше гипотетическая формула глюкозы кажется поэтому правдоподобной. Она подлежит, однако, тщательной проверке. Для того чтобы доказать, что эта формула правильно отображает строение глюкозы, необходимо подтвердить наличие у глюкозы всех свойств, присущих как альдегидам, так и спиртам, и, кроме того, доказать присутствие в молекуле глюкозы именно пяти спиртовых групп. [c.178]Новейшие химические и рентгеноскопические исследования показали, что крахмал и целлюлоза состоят из остатков глюкозы, связанных глюкозидными связями, но, несмотря на большое химическое сходство, крахмал и целлюлоза отличаются друг от друга и по строению и по свойствам. Крахмал представляет собой зерна и сферокристаллы, которые можно растереть в мелкий порошок, а целлюлоза—нити и волокна, прочные на разрыв. Роль крахмала и клетчатки в растениях различна крахмал является питательным веществом, тогда как клетчатка—опорной тканью. [c.536]
Приведите перспективные формулы (по Хеуорсу) фрагментов молекул амилозы и амилопектина. Укажите типы связей между остатками D-глюкозы. Отметьте отличия в строении и свойствах амилозы и амилопектина. [c.138]
Деструкция полимеров — это разрушение макромолекул — под действием различных физических и химических агентов. В результате деструкции, как правило, уменьшается молекулярная масса полимера, изменяется его строение, а также физические и механические свойства полимер становится непригодным для практического использования. Следовательно, этот процесс является нежелательной побочной реакцией при химических превращениях, переработке и эксплуатации полимеров. В то же время реакции деструкции в химии высокомолекулярных соединений играют и положительную роль. Эти реакции используют для получения ценных низкомолекулярных веществ нз природных полимеров (например, аминокислот из белков, глюкозы из крахмала), а также для частичного снижения молекулярной массы полимеров с целью облегчения их переработки. С помощью некоторых деструктивных процессов можно определять строение исходных полимеров и сополимеров. Процессы, приводящие к разрыву химических связей в макромолекулах, как уже отмечалось, используют для синтеза привитых и блок-сополимеров. [c.67]
Глюкоза — органическое бифункциональное соединение. Строение ее молекулы было установлено на основании изучения химических свойств. В конце 60-х годов прошлого столетия А. А. Колли доказал, что в молекуле глюкозы имеется пять гидроксогрупп. Шестой кислородный атом входит в состав альдегидной группы, так как глюкоза дает качественную реакцию на альдегидную группу. В частности, она окисляется оксидом серебра (реакция серебряного зеркала). В молекуле глюкозы одна альдегидная группа [c.354]
Углеводы. Классификация углеводов. Глюкоза, ее строение и свойства. Фруктоза как изомер глюкозы. Сахароза и ее гидролиз. Крахмал и целлюлоза. Их строение и свойства. Применение углеводов. [c.224]
Известны две кристаллические модификации О-глюкозы. Одна из них—а-глюкоза—представляет собой природный виноградный сахар кристаллизуется из воды при температуре выше 30° С. Вторая — Р-глюкоза — получается, если нагревать концентрированный раствор глюкозы в течение нескольких часов при температуре около 110° С, а затем для выделения кристаллов разбавить спиртом. Строение, физические и оптические свойства а- и р-глю-козы рассмотрены на стр. 229—232. [c.247]
Зная строение глюкозы, можно теперь познакомиться с ее свойствами, написать схемы ее химических превращений. При этом глюкоза будет изображаться то в альдегидной, то в циклической форме. Поскольку они находятся в равновесии друг с другом, удаление одной из них в ходе реакции будет сдвигать равновесие в сторону реагирующей формы. Таким образом, несмотря на малое содержание альдегидной формы, глюкоза может быть полностью пре- [c.286]
Например, низкомолекулярные ацетали при гидролизе распадаются на альдегиды и спирты, значительно отличающиеся по свойствам от исходного ацеталя и друг от друга и благодаря этому легко поддающиеся разделению. При полном гидролизе полисахаридов образуются низкомолекулярные монозы, которые легко отделить от полимера (например, глюкозу от целлюлозы или крахмала). При частичной же деструкции полимеров получается гамма продуктов деструкции, занимающих промежуточное положение между исходным полимером и мономером. При этом химическая природа исходного полимера сохраняется в продуктах его частичной деструкции и вновь образовавшиеся вещества отличаются от исходного полимера только по молекулярной массе. Исключением является полная деструкция полимера до мономера, который имеет строение, отличное от элементарного звена полимера. [c.222]
Формально образование полисахаридов из моносахаридов можно представить как превращение полуацетальной функции в ацетальную (гликозиды) за счет соединения гидроксильной группы одной молекулы сахара с гидроксильной группой другого моносахарида. В результате возникает цепочка последовательно соединенных через кислородные атомы остатков сахаров. Точно так же как при превращении глюкозы в метилглюкозид образуются два аномерных продукта (разд. 17.2.1), так и стереохимия кислородных мостиков между остатками сахаров может быть различной. Существенное отличие биологических свойств различных полисахаридов обусловлено особенностями пространственного строения эфирных мостиков. [c.280]
Химические свойства глюкозы обусловлены ее строением. Как спирт она вступает в реакции этерификации с кислотами, например [c.231]
Такое строение сахарозы обусловливает ее свойства в отличие от глюкозы она не вступает ц реакции, характерные для альдегидов. [c.232]
Свойства различных органических (и неорганических) вешеств зависят от их химического состава, и строения. Очень большую роль играет величина молекулы вещества. Так, например, сахаристое вещество глюкоза, с которым мы познакомились при изучении углеводов, представляет собой легко растворимые в воде бесцветные кристаллы, сладкие на вкус. В той же главе мы рассмотрели другой углевод — целлюлозу, построенную из нескольких тысяч остатков глюкозы. Целлюлоза совершенно не похожа по свойствам на глюкозу она нерастворима в воде, не имеет вкуса, обладает волокнистым строением. Таким образом, при переходе к соединениям, молекулы которых содержат многие тысячи атомов, блестяще подтверждается один из законов диалектики, по которому накопление количественных изменений приводит к значительным качественным изменениям. [c.364]
Очевидно, глюкоза, как следует из строения ее молекулы, должна обладать свойствами и спирта и альдегида. Как спирт она образует сложные эфиры. Как альдегид она восстанавливается в шестиатомный спирт (сорбит) [c.398]
Из этой темы учащиеся самостоятельно изучают вопросы физические свойства и нахождение в природе (в классе), химическое строение гл
www.chem21.info
2. Строение и биологическая роль глюкозы и гликогена. Синтез и распад гликогена.
Эмпирическая формула глюкозы С6Н12О6. Она может иметь различные пространственные формы. В организме человека глюкоза как правило находится в циклической форме:
Свободная глюкоза в организме человека в основном находится в крови, где ее содержание довольно постоянно и колеблется в диапазоне от 3,9 до 6,1 ммоль/л.
Глюкоза главный источник энергии в организме.
Другим углеводом типичным для человека является гликоген. Состоит гликоген из сильно разветвленных молекул большого размера, содержащих десятки тысяч остатков глюкозы. Эмпирическая формула гликогена: (С6 Н12 О5)n где n число остатков глюкозы.
Основные запасы гликогена сосредоточены в печени и мышцах.
Гликоген является запасной формой глюкозы.
В норме с пищей поступает 400-500 г углеводов. Это, главным образом, крахмал, клетчатка, сахароза, лактоза, гликоген. Переваривание углеводов происходит в разных частях пищеварительного тракта, начиная с ротовой полости. Осуществляют его ферменты амилазы. Единственный углевод, который не расщепляется в нашем организме – это клетчатка. Все остальные расщепляются до глюкозы, фруктозы, галактозы и.т. д. и вовлекаются в процессы катаболизма, Значительная часть глюкозы превращается в печени в гликоген. Между приемами пищи часть гликогена в печени превращается в глюкозу, которая поступает в кровь.
Глюкоза, используемая для синтеза гликогена, предварительно активируется. Затем после ряда превращений образует гликоген. В этом процесс участвует нуклеотид УТФ (уридинтрифосфат), который по строению напоминает АТФ. В ходе реакций образуется промежуточное соединение – уридиндифосфатглюкоза (УДФ-глюкоза). Именно это соединение образует молекулы гликогена, вступая в реакцию с так называемой затравкой. Затравкой служат имеющиеся в печени молекулы гликогена.
Реакции образования гликогена обеспечиваются энергией молекулами АТФ. Синтез гликогена ускоряется гормоном инсулином.
Распад гликогена в печени осуществляется в обратном порядке и в конечном итоге образуется глюкоза и фосфорная кислота. Этот процесс ускоряется гормонами глюкагоном и адреналином. Распад гликогена в мышцах стимулирует гормон адреналин, который выделяется в кровь во время мышечной работы. При этом в мышцах не образуется свободная глюкоза и путь расщепления гликогена несколько иной.
3. Катаболизм углеводов. Гексозодифосфатный путь расщепления глюкозы.
Катаболизм глюкозы осуществляется двумя путями.
Основная часть углеводов (до 95%) подвергается распаду по гексозодифосфатному пути. Именно этот путь является основным источником энергии для организма.
Остальная часть глюкозы расщепляется через гексозомонофосфатный путь.
ГДФ-путь может протекать в условиях отсутствия кислорода – анаэробно и в присутствии кислорода, то есть в аэробных условиях. Это очень сложная цепь последовательных реакций, конечным результатом которой является образование углекислого газа и воды. Этот процесс можно разбить на три этапа, последовательно идущих друг за другом.
Первый этап, называемый гликолизом, происходит в цитоплазме клеток. Конечным продуктом этого этапа является пировиноградная кислота.
1. Реакция фосфорилирования молекулы глюкозы состоит в том, что глюкоза при участии тканеспецефичного фермента гексокиназы с затратой энергии 1 молекулы АТФ превращается в глюкозо-6фосфат.
Глюкоза + АТФ → глюкоза-6-фосфат + АДФ
2. Глюкоза-6-фосфат превращается во фруктозо-6-фосфат
3. Фруктозо-6-фосфат переходит во фрутозо-1.6-фосфат
4. Далее из фруктозо-6-фосфата образуется фосфоглицериновый альдегид.
5.Затем из фосфоглицеринового альдегида образуется 1.3дифосфоглицерат
6. 1.3дифосфоглицерат переходит в3-фосфоглицерат,
7 который переходит в 2-фосфоглицерат, а затем
8 в фосфопируват, а тот
9 в пируват (пировиноградная кислота).
Общее уравнение гликолиза выглядит так:
Глюкоза + О2 + 8АДФ + 8 Н3РО4 → 2 Пируват + 2Н2О + 8 АТФ
Первый этап распада углеводов практически обратим. Из пирувата, а также из возникающего в анаэробных условиях лактата (молочная кислота), может синтезироваться глюкоза, а из неё гликоген.
Второй и третий этапы ГДФ-пути протекают в митохондриях. Эти этапы требуют присутствия кислорода. В ходе второго этапа от пировиноградной кислоты отщепляется углекислый газ и два атома водорода. Отщепленные атомы водорода по дыхательной цепи передаются на кислород с одновременным синтезом АТФ. Из пирувата же образуется уксусная кислота. Она присоединяется к особому веществу, коферменту А. Это вещество является переносчиком остатков кислот. Результатом этого процесса является образование вещества ацетилкофермент А. Это вещество обладает высокой химической активностью.
Итоговое уравнение второго этапа ГДФ-nути:
О
11
СЗН4ОЗ+ 1/2О2+ HSKoA + 3 АДФ + 3 НзРО4 СНз— С ~ SKoA + СО2+ Н2О + 3АТФ
Пируват Кофермент А Ацетил-КоА
Ацетилкофермент А подвергается дальнейшему окислению в цикле трикарбоновых кислот (цикл Кребса) и превращается в СО2 и Н2О. Это и есть третий этап. За счёт выделяющейся энергии на этом этапе также осуществляется синтез АТФ.
Цикл трикарбоновых кислот (ЦТК) — это завершающий этап катаболизма не только углеводов, но и всех остальных классов органических соединений. Это обусловлено тем, что при распаде углеводов, жиров и аминокислот образуется общий промежуточный продукт — уксусная кислота, связанная со своим переносчиком — коферменгом А — в форме ацетилкофермента А.
Вышесказанное можно иллюстрировать следующей схемой:
Белки Углеводы Жиры
Ацетил-КоА
СО2 Н2О
Цикл Кребса протекает в митохондриях с обязательным потреблением кислорода и требует функционирования тканевого дыхания.
Первой реакцией цикла является взаимодействие ацетилкофермента А со щавелево-уксусной кислотой(ЩУК) с образованиемлимонной кислоты.
СООН
СООН 1
1 С Н2
СНз + С Н2 1
1 1 + Н2О НО – С – СООН + НS ~ KoA
С=О С=О 1
SKoA 1 С Н2 Кофермент А
СООН 1
СООН
Ацетил-КоА ЩУК Лимонная кислота
Лимонная кислота содсржит три карбоксильные группы, т. е. является трикарбоновой кислотой. что обусловило название этого цикла.
Поэтому эти реакции и называют циклом лимонной кислоты. Образуя ряд промежуточных трикарбоновых кислот, лимонная кислота вновь превращается в щавелево-уксусную и цикл повторяется. Результатом этих реакций является образование отщепленного водорода, которые, пройдя по дыхательной цепи (см. предыдущую лекцию), образует с кислородом воду. . Перенос каждой пары атомов водорода на кислород сопровождается синтезом трех молекул АТФ. Всего при окислении одной молекулы ацетилкофермента А синтезируется 12 молекул АТФ.
Итоговое уравнеuие цикла Кребса (третьего этапа ГДФ-nутu):
О
11
СНз — С ~ SKoA + 2О2 + Н2О + 12АДФ + 12 Н3РО НSKoA + 2 СО2 + Н2О + 12АТФ
Ацетил-КоА
Схематично цикл Кребса можно представить следующим образом:
Лимонная
Кислота (С6)
НSKoA СО2
Ацетил-КоА 2Н(+ 1/2О2,
–3АТФ)
Щавелево-уксусная α-кетоглутаровая
кислота (С4) кислота (С5)
СО2
2Н(+1/2О2,
2Н(+1/2О2, –3АТФ)
–3АТФ)
Яблочная Янтарная
кислота (С4) кислота (С4)
2Н(+ 1/2О2, –3 АТФ)
В результате всех этих реакции образуется 36 молекул АТФ. В сумме ГДФ-путь дает 38 молекул АТФ в пересчете на одну молекулу глюкозы
Глюкоза + 6 О2 + 38 АДФ + 38 Н3 РО4 → 6СО2 + 6 Н2О +38 АТФ
Расщепление гликогена добавляет к этому уравнению еще одну молекулу АТФ,
При недостатке кислорода аэробный путь прерывается образованием пирувата, который превращается в лактат. В результате таких превращений образуется лишь две молекулы АТФ.
Общая схема ГДФ-пути выглядит так:
Гликоген Глюкоза
Глюкозо-6- фосфат
Пировиноградная кислота
Ацетилкофермент А Лактат
(2 молекулы АТФ при распаде 1молекулы глюкозы)
Н2О CO2
( 38 молекул АТФ при распаде
1 молекулы глюкозы и 39АТФ
при распаде 1 молекулы гликогена)
studfiles.net
